eISSN 2444-7986
DOI: https://doi.org/10.14201/orl.26581
ARTÍCULO DE REVISIÓN
MANIFESTACIONES DE CABEZA Y CUELLO SECUNDARIAS AL USO DE COCAÍNA. REVISIÓN BIBLIOGRÁFICA
Head and neck manifestations of cocaine abuse. Review
Beatriz PALMERO-SÁNCHEZ1; Gianni FAELENS2; Patricia CORRIOLS-NOVAL3; Eugenia LÓPEZ-SIMON3; Carmelo MORALES-ANGULO3
1 Facultad de Medicina. Universidad de Cantabria. España. 2 General practicioner. Hospital De Pretlei. Bélgica 3Servicio de Otorrinolaringología. Hospital Universitario Marqués de Valdecilla. Santander. España
Correspondencia: patri16.92@gmail.com
Fecha de recepción: 3 de junio de 2021
Fecha de aceptación: 3 de agosto de 2021
Fecha de publicación: 6 de octubre de 2021
Fecha de publicación del fascículo: 31 de marzo de 2022
Conflicto de intereses: Los autores declaran no tener conflictos de intereses
Imágenes: Los autores declaran haber obtenido las imágenes con el permiso de los pacientes
Política de derechos y autoarchivo: se permite el autoarchivo de la versión post-print (SHERPA/RoMEO)
Licencia CC BY-NC-ND. Licencia Creative Commons Atribución-NoComercial-SinDerivar 4.0 Internacional
Universidad de Salamanca. Su comercialización está sujeta al permiso del editor
RESUMEN: Introducción y objetivo: El consumo de cocaína se ha asociado a patología a múltiples niveles, pero ésta es especialmente relevante a nivel de cabeza y cuello, por ser la vía intranasal una de sus más frecuentes vías de consumo. Este trabajo describe las principales manifestaciones clínicas del consumo de cocaína en el área otorrinolaringológica, y se analizan algunos de los diagnósticos diferenciales que se han de descartar. Método: Se realizó una revisión bibliográfica vía, PubMed, Cochrane y Google Schoolar con artículos publicados entre 1999 y 2019 con la palabra cocaine junto con diferentes términos de búsqueda, siguiendo los criterios PRISMA para la selección de artículos. Resultados: La búsqueda inicial redujo los artículos a 641, finalizando la selección en 63 artículos, a los cuales se añadieron otros 66 desde otras fuentes. Finalmente, 129 artículos fueron incluidos en la presente revisión sistemática. Conclusiones: La necrosis de la línea media y la perforación septal son las manifestaciones más frecuentemente descritas asociadas al abuso de cocaína. Sin embargo, esta sustancia puede originar otras muchas lesiones en cabeza y cuello, generalmente de difícil diagnóstico, sobre todo cuando el paciente niega el abuso de sustancias.
PALABRAS CLAVE: cocaína; otorrinolaringología; CIMDL; evamisol; cabeza y cuello
SUMMARY: Introduction and objective: Cocaine abuse has been linked to pathology in multiple levels, but especially relevant are the ones located in the head and neck area, since one of the most used routes of administration is precisely through the nose (snorted). This paper describes the main clinical manifestations of cocaine use in the otolaryngologic area, and analyses some of the differential diagnoses that must be ruled out. Method: A systematic review was conducted via PubMed, Cochrane and Google Schoolar with articles published between 1999 and 2019 using the word «cocaine» together with some other search terms, following the PRISMA criteria for the selection of articles. Results: The initial search reduced the articles to 641, from which 63 articles were selected based on their content. In addition to those, another 66 were added from different sources. Finally, 129 articles were included in this systematic review. Conclusions: Midline necrosis and septal perforation are the most common manifestations described as due to cocaine abuse. However, this substance can cause many other head and neck lesions, usually difficult to diagnose, especially when the patient denies substance abuse.
KEYWORDS: cocaine; otolaryngology; CIMDL levamisole; head and neck
INTRODUCCIÓN
La cocaína es una sustancia obtenida de Erythroxylum coca [1,2], planta autóctona del norte de América del Sur [3] utilizada desde hace miles de años por culturas andinas para reducir los síntomas asociados a vivir a gran altitud [2,4]; y todavía es un hábito común entre algunas tribus indígenas del Amazonas central y América del sur [5]. El clorhidrato de cocaína fue aislado por primera vez de sus hojas en 1860, e introducida en la medicina en 1884 por Koller como un anestésico local [2,4].
Aunque actualmente la mayor parte de su consumo se realiza de forma ilegal, aún tiene un pequeño número de aplicaciones médicas aceptadas, especialmente como anestésico local y antihemorrágico en la cirugía nasal, con la ventaja sobreañadida de ser un potente vasoconstrictor [6-7].
La cocaína es un alcaloide cristalino [1,2,8] con un pH ácido, cercano a 4 [9-11]. Se encuentra en dos formas químicas, la sal de clorhidrato o polvo de cocaína, que se consume vía inhalada o inyectada, y los cristales de cocaína o cocaína base, conocida también como freebase o crack [2]. El nombre crack viene del sonido que producen los cristales al calentarse [12].
La cocaína se absorbe a través de membranas mucosas [16]; por lo que existen diferentes vías de administración: [2,11,13-16]
• Vía inhalada (vía nasal): es la vía más frecuente de consumo; con una absorción sanguínea muy rápida.
• Vía tópica: también frecuente, habitualmente se aplica sobre la mucosa gingival.
• Vía intravenosa: paso directo a la sangre. También es frecuente la inyección simultánea de cocaína y heroína en lo que se conoce como speedballing.
• Fumada: menos frecuente. Mediante esta vía la cocaína pasa a la sangre a la misma velocidad que si fuese inyectada, por lo que el efecto es casi inmediato. Es la forma de consumo de la cocaína crack; habitualmente mediante una pipa de agua, pero también se puede fumar como un cigarro mezclando esta con tabaco o marihuana.
• Vía oral: ingerida, mezclada con cócteles. Forma menos frecuente de consumo [17].
La cocaína se considera la segunda droga recreativa más utilizada tanto en Europa como en Estados Unidos después del cannabis; y la primera dentro de las drogas estimulantes entre los usuarios jóvenes, por delante de las anfetaminas o el éxtasis sobre todo en el sur y oeste europeo [18].
Se estima que cerca del 5% de los adultos europeos (unos 17-18 millones de personas) han consumido cocaína por lo menos una vez a lo largo de su vida, y de ellos, entre los jóvenes adultos (entre 15 y 34 años) se estima que alrededor de un 2% (unos 2.6 millones) lo han hecho en el último año [19].
Los países con mayor prevalencia de consumo son España, Países Bajos, Reino Unido, Irlanda, Dinamarca y Francia; aunque el consumo en Europa del este, donde clásicamente había sido menor, está aumentando [18].
El consumo entre hombres y mujeres varía enormemente entre un país y otro, llegando a ratios desde el 1:1 al 13:1 [19].
La cocaína actúa a través de la vía mesolímbica, relacionada con el mecanismo cerebral que media la recompensa, y tras un breve uso tiene un alto riesgo de causar dependencia. Atraviesa fácilmente la barrera hematoencefálica e inhibe la recaptación de serotonina, norepinefrina y noradrenalina, aumentando la concentración de estos neurotransmisores en la hendidura sináptica, causando en conjunto una estimulación del sistema nervioso simpático [1,2,9,14,20-26].
El consumo de cocaína puede causar patología en múltiples órganos siendo los más importantes los efectos a nivel cardiovascular (hipertensión, taquicardia, arritmias, dolor torácico, infarto de miocardio, accidente cerebrovascular hemorrágico, disección aórtica, ruptura de aneurismas…) y los efectos a nivel neuropsiquiátrico (por una parte comienza con euforia y sensación de bienestar, pero puede llevar a estados psicóticos, alucinaciones, paranoia y depresión; y por otra, produce agitación, mareos, cefalea, convulsiones, midriasis, hipertermia, ansiedad, insomnio, bruxismo …) [3,13].
También incluye otros síntomas como dolor abdominal, y patología pulmonar (hipoxemia, hemoptisis, broncoespasmo, etc.), síndrome gripal y signos como la eosinofilia [15].
Además, es frecuente que la cocaína se encuentre mezclada con otras sustancias que pueden contribuir a la toxicidad [19] de los cuales el más frecuente es el Levamisol, un antihelmíntico veterinario, que puede provocar agranulocitosis y vasculitis como principales efectos secundarios [27,28].
Entre los efectos más comunes del uso de cocaína están los producidos sobre el área de cabeza y cuello. Esto se debe a que su ruta de consumo más habitual es la inhalación intranasal, provocando lesiones en toda esta región. Este daño a nivel local es sobre todo secundario al efecto vasoconstrictor de la cocaína, que produce isquemia local y necrosis [41-43] favorecido a su vez por el efecto anestésico de la cocaína [4].
Así, puede aparecer daño en las fosas nasales, desde obstrucción nasal, anosmia y epistaxis hasta perforación del tabique, y en casos severos destrucción de la pirámide nasal y deformación en silla de montar, por la pérdida del soporte cartilaginoso. En los senos paranasales puede producir destrucción de las paredes, sinusitis y sobreinfección; en la cavidad oral perforaciones palatinas, ageusia, enfermedad periodontal, patología dentaria, insuficiencia velopalatina y disfagia, e incluso la destrucción puede avanzar hasta la cavidad orbitaria generando diplopía, neuropatía, ceguera, celulitis u oclusión de la vena central de la retina. En casos aislados puede producir afectación de la base de cráneo generando fístulas de líquido cefaloraquídeo, exposición ósea de la base del cráneo, abscesos cerebrales o inestabilidad atlantoaxial [29-36].
El objetivo de este estudio es describir conjuntamente las diversas manifestaciones que del consumo de cocaína en el área de cabeza y cuello.
MATERIAL Y MÉTODO
Se realizó una selección de los artículos publicados entre enero de 1999 y diciembre de 2019 en las bases de datos PubMed, Cochrane y Google Schoolar. La búsqueda fue realizada en diciembre de 2019 utilizando el término cocaine junto con alguno de los términos: head and neck, neck, otorhinolaryngology, nasal, nasal cavity, paranasal, sinus, sinusitis, cartilage, nose, snorting, intranasal, palate, oral cavity, midline, midfacial, pharynx, nasopharynx, oropharynx, hypopharynx, larynx, glottis, throat, hearing loss, ear, otitis, vertigo, tongue, mediastinum, orbit o ulcer.
Se siguieron los criterios PRISMA para la selección de artículos. Los resultados de la búsqueda se limitaron a estudios en humanos escritos en inglés, español, francés y portugués. Posteriormente, se seleccionaron parte de los artículos de la búsqueda inicial mediante revisión de su título y resumen, y después se investigó el texto completo de los artículos seleccionados.
Los criterios de exclusión de los artículos eliminados incluyen: publicación redundante, artículos en otro idioma (más allá de los previamente mencionados) y estudios en animales.
RESULTADOS
El proceso de búsqueda redujo los artículos a 641 títulos, cuyo resumen fue sometido a evaluación tras eliminar 374 trabajos duplicados.
Mediante la lectura de los resúmenes, se eliminaron 131 artículos adicionales por no cumplir los criterios de inclusión o por no tener relación con el tema a tratar, y posteriormente se procedió a la lectura del artículo completo, finalizando la selección inicial en 63 artículos. Además, se incluyeron otros 66 artículos desde la bibliografía de los artículos originales.
Finalmente, 129 artículos fueron incluidos en la presente revisión sistemática [1-6,8-13,15-37; 39-49; 51-74; 77; 80-84; 86-97; 99-113; 115-134; 136-141].
El proceso de selección de los artículos está representado según el diagrama PRISMA (Figura 1).
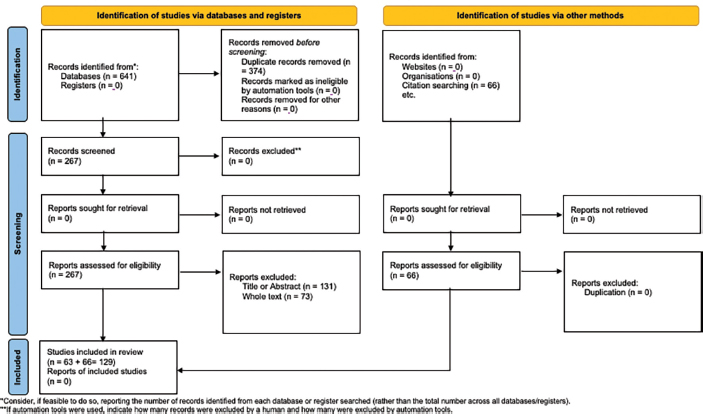
Figura 1. Diagrama PRISMA con la representación de los artículos incluidos en la revisión.
DISCUSIÓN
LESIONES DESTRUCTIVAS DE LÍNEA MEDIA INDUCIDAS POR COCAÍNA
El consumo de cocaína vía inhalada está asociado a una inflamación crónica de la mucosa nasosinusal que puede progresar lentamente hacia la destrucción de nariz, paladar y tejidos faríngeos y paranasales. Estas lesiones características se denominan lesiones destructivas de la línea media inducidas por cocaína (o CIMDL, del inglés cocaine-induced midline destructive lesions) [37].
Cuando el consumo de cocaína vía nasal es crónica y continuada, puede producir rinitis, obstrucción nasal crónica, epistaxis y dolor facial severo. En la exploración física se pueden observar lesiones necrotizantes ulcerativas, costras extensas e incluso perforaciones septales (cuando hay un daño en el pericondrio y el cartílago que se nutre a través de el se necrosa), que frecuentemente son indoloras y bien toleradas debido al efecto anestésico de la cocaína, pero que sin embargo producen rinolalia e insuficiencia respiratoria nasal [1,38].
Para poder hablar de CIMDL, se requiere la presencia de al menos dos de los siguientes signos: perforación septal, destrucción de la pared lateral nasal y/o afectación o perforación del paladar duro [1].
Esta destrucción habitualmente afecta al vómer, la lámina perpendicular del etmoides, al proceso palatino del hueso maxilar, los huesos palatinos y al cornete nasal inferior; si el daño es más extenso, también puede afectar a cornete medio, paredes mediales de los senos maxilares, senos etmoidales y lámina cribiforme de la base de cráneo anterior [1,39]. Menos frecuentemente, puede afectar también a cornete superior, esfenoides e incluso a la órbita [40].
Las mujeres son, en general, más susceptibles a la perforación completa del paladar y al desarrollo de un mayor componente inflamatorio en los tejidos conectivos, óseos y cartilaginosos [47]. Además, estas lesiones se pueden complicar con infecciones secundarias y osteonecrosis [1,41-42].
El mecanismo subyacente es multifactorial, ya que, a pesar de lo generalizado del consumo, estas lesiones se encuentran únicamente en unos pocos pacientes [43]. Este mecanismo está principalmente relacionado con el efecto vasoconstrictor de la cocaína, que produce isquemia local y necrosis tisular cuando es consumida de manera continuada en el tiempo [28,44]. También juega un papel importante el traumatismo local directo debido a la impactación a gran velocidad de los cristales inhalados [28,44] Además, también influyen las propiedades protrombóticas de la cocaína y de los aditivos que puedan estar presentes, y el propio efecto citotóxico directo de la cocaína, que induce apoptosis de las células de la mucosa nasal [31,44].
Por último, la infección secundaria de las lesiones puede aumentar aún más el daño local [1,45,46]; infecciones favorecidas por el hecho de que los individuos que consumen cocaína están inmunológicamente deprimidos [47-49]. En un estudio realizado por Trimarchi et al, se documentó que hasta un 88% de los pacientes con CIMDL tenían cultivos positivos para Staphylococcus aureus y además la disminución de la presión de oxígeno en la mucosa nasal puede facilitar el crecimiento de patógenos anaerobios [50-55].
En las muestras de anatomía patológica obtenida de pacientes con CIMDL, en general se han observado lesiones inespecíficas, inflamación crónica y ulceraciones, tejido granulomatoso con infiltrado inflamatorio mixto (neutrófilos, eosinófilos, células plasmocitarias), vasculitis (inconstante), cambios vasculares por microtrombosis y necrosis fibrinoide [50-51].
El diagnóstico final se basa en gran medida en la historia clínica y la documentación del consumo de cocaína o antecedentes del mismo, y la exclusión de otras posibles etiologías como pueden ser enfermedades vasculares, inflamatorias, tumores o infecciones [5,52-56].
El diagnóstico diferencial de la CIMDL es amplio y se debe hacer principalmente con lo que anteriormente se conocía como granuloma maligno de la línea media, e incluía la granulomatosis con poliangeitis y el linfoma de células NK/T, la sarcoidosis, infecciones (sífilis terciaria, tuberculosis, lepra, leishmaniasis o por hongos como es el caso de la actinomicosis o mucormicosis), policondritris recurrente, rinoscleroma, enfermedad relacionada con IgG4, esclerosis inflamatoria orbitaria idiopática o pseudotumor esclerosante orbitario [52-60].
EXTENSIÓN DE LA CIMDL FUERA DEL ÁREA NASOSINUSAL
Una vez establecida la lesión nasal, esta puede progresar hasta estructuras próximas como la órbita dando una oftalmoplejía restrictiva, e incluso presentar afectación intracraneal [60-64]. Otro factor que podría contribuir a la aparición de diplopía es la asociación del consumo de cocaína con miastenia gravis, para lo cual es útil la determinación de auto-anticuerpos [65].
También puede dar lugar a la aparición de un pneumocele orbitario a tensión como consecuencia de la dehiscencia de la lámina papirácea que es mucho más prevalente en individuos que consumen cocaína vía inhalada, que puede acabar provocando proptosis y compresión del nervio óptico o una neuritis óptica [66-67].
La progresión de la enfermedad puede hacer que ésta avance hasta afectar a otras estructuras óseas como el clivus aumentando enormemente el riesgo de infección intracraneal, provocando un absceso cerebral o fístulas del LCR por aparición de solución de continuidad en la base de cráneo [68-69].
Otras manifestaciones nasosinusales: lesiones que simulan un angiosarcoma [131]. tumor fibroso solitario, tumor inflamatorio de Pott (absceso subperióstico del hueso frontal, asociado a osteomielitis del mismo hueso) [70-74].
NECROSIS INDUCIDA POR LEVAMISOL
El levamisol es un antihelmíntico con propiedades inmunomoduladoras, que ha tenido indicaciones muy concretas para el tratamiento del síndrome nefrótico en niños y como quimioterápico en el tratamiento del carcinoma colorrectal [75-79].
En la actualidad, el levamisol se utiliza como aditivo de la cocaína, principalmente por su capacidad para potenciar los efectos psicotrópicos de la cocaína [76-77].
Dentro de los posibles efectos tóxicos que el levamisol puede inducir en el organismo, se encuentra en primer lugar la agranulocitosis, la vasculitis de pequeño vaso que favorece la trombosis y conduce a necrosis tisular, la neutropenia (en posible relación con un efecto depresor de la médula ósea) y la aparición de púrpura retiniforme [78-81].
Esta última, supone el efecto visible más frecuente, y puede evolucionar hasta la necrosis cutánea. Sin embargo, a pesar de lo generalizado de su uso, el número de casos documentados de lesiones cutáneas necróticas asociadas al consumo de cocaína es relativamente bajo [82].
La vasculitis cutánea relacionada con la cocaína adulterada con levamisol (o LAC, del inglés levamisol adultered cocaine) es un diagnóstico de exclusión que debe ser considerado en pacientes con antecedentes de consumo de cocaína y púrpura palpable o flictenas con afectación del pabellón auricular, artralgias, neutropenia y ANCAS a títulos altos con anticuerpos antimieloperoxidasa negativos [83].
La razón por la cual el estudio de la vasculitis inducida por levamisol afecta en parte al área específica de la otorrinolaringología es que esta habitualmente involucra la nariz, los lóbulos de las orejas y la región malar aunque se desconoce por qué hay una predilección por la afectación por estas áreas de cabeza y cuello en la toxicidad del levamisol [82].
Dentro de la histología de estas lesiones, lo más frecuente es que aparezca una vasculopatía protrombótica con microtrombos de fibrina, con o sin vasculitis leucocitoclástica de pequeño vaso asociada; siendo la aparición de una vasculitis leucocitoclástica aislada la manifestación menos frecuente de ellas [83].
Una revisión más amplia de Poon et al reveló una frecuencia similar de trombosis microvascular en casos de sospecha de levamisol tóxico: las biopsias mostraron únicamente patología trombótica en 14 de 22 casos (64%), características trombológicas y vasculíticas en 7 de 22 casos (32%), y únicamente vasculitis en solo 1 caso (4%) [62].
El tratamiento de las lesiones cutáneas inducidas por el consumo de cocaína adulterada con levamisol va a depender de la gravedad del cuadro. El cese del consumo de cocaína es fundamental para la resolución de las lesiones; ya que en muchas ocasiones el cuadro cede únicamente con estas medidas [36-38,93] y reaparece o se exacerba tras un nuevo consumo [62].
Los corticosteroides sistémicos pueden ser de utilidad, y de hecho se utilizan frecuentemente [147], pero también aumentan el riesgo de infecciones secundarias, por lo que se recomienda que solo sean utilizados en los casos más graves [62].
El desbridamiento quirúrgico de las regiones necróticas puede ser un enfoque inicial en los casos más severos [84].
LESIONES EN LA CAVIDAD ORAL
El consumo de cocaína, tanto por vía nasal como por otras vías, puede provocar múltiples afecciones en la cavidad oral [85-93]. Un estudio realizado por la Escuela de Odontología de la Universidad Federal de Bahía (Brasil) documentó una prevalencia de patología oral del 25% en los pacientes adictos a la cocaína frente al 9,9% de los controles que no consumían. Entre las lesiones más frecuentes se encontraban la úlcera traumática (7,5%), la queilitis actínica (7,5%) y las fístulas asociadas a raíz dentaria retenida (secuestro óseo, 5%) [86].
Las posibles lesiones que pueden aparecer en la cavidad oral se resumen en la Tabla 1 [90-97].
Tabla 1. Manifestaciones derivadas del consumo de cocaína en la cavidad oral.
Mucosa oral [157] |
Por efecto citolítico: |
Por contacto directo: [17, 160-162] |
Encías y mucosa gingival |
Retracción gingival [154, 165] |
Caries [3,17, 165-168] |
Aparato masticatorio |
Dolor articulación temporomandibular [3,13, 154, 165, 171] |
|
Otras manifestaciones infrecuentes |
Síndrome de Stevens-Johnson [172] |
Pénfigo vulgar [178, 179] |
Las lesiones en la mucosa oral están asociadas mayormente al calor derivado de fumar crack, pero también pueden asociarse con la progresión de la necrosis nasosinusal por el consumo de cocaína vía inhalada [86-90]. El principal Son tanto el efecto vasocontrictor como un daño caústico sobre la mucosa oral [90].
Las lesiones en las encías suelen estar relacionadas con un cepillado dentario excesivamente vigoroso durante los picos de efecto de la droga, aunque la aplicación directa de la cocaína sobre dicha región también puede provocar la aparición de lesiones [86-87]. Además, estos pacientes tienen tasas más altas de caries, periodontitis y candidiasis por malos hábitos de higiene oral [3,17,91].
A nivel del aparato masticatorio la erosión dentaria por bruxismo severo reporte secundariamente provocando disfunción de la articulación temporomandibular [3,13]. Además, el consumo de cocaína inmediatamente antes o después de la extracción dental puede provocar una hemorragia excesiva [16-17].
El tratamiento se basa en el cese del consumo de cocaína. La inmunosupresión mediante prednisona oral a dosis altas o el empleo de micofenolato de mofetilo han demostrado ser útiles en el control y regresión de las lesiones si se mantiene la abstinencia en el consumo de cocaína [98].
INSUFICIENCIA VELOPALATINA
Cuando el daño producido por el consumo de cocaína vía intranasal afecta a la musculatura velofaríngea, puede dar lugar a una insuficiencia velopalatina. Esta consiste en un defecto de cierre entre la oro y nasofaringe, a cargo del esfínter conformado por el músculo constrictor superior de la faringe y el paladar blando [99-105].
Dada la incidencia de consumo de cocaína y la escasez de casos descritos en la literatura, es probable que la incidencia de esta patología esté infraestimada [99].
La clínica habitual incluye insuficiencia nasal (con regurgitación nasal de comida y bebida), rinolalia (especialmente marcada a la hora de pronunciar consonantes cerradas) y mala inteligibilidad del habla como síntomas cardinales, pero también se ha asociado a anosmia, boca seca, dificultad para sonarse la nariz, para conciliar el sueño, ronquidos e incluso estenosis nasofaríngea [99].
Para el diagnóstico, además de la clínica es útil realizar un examen oral para ver si el paladar se retrae y si se observa la úvula [99].
En cuanto al tratamiento lo más importante es el abandono del hábito de consumo; después, se puede dividir entre un manejo conservador o quirúrgico (que a su vez incluye prótesis para cubrir defectos como perforaciones para el alivio sintomático, y colgajos tanto libres como locales) [99-101,104].
PÉRDIDA DE AUDICIÓN
El mecanismo mediante el cual el consumo de cocaína produce pérdida auditiva [106-109] todavía está por esclarecer, pero se han descrito varios mecanismos [106-115]:
• Anoxia coclear secundaria a la vasoconstricción. En esta situación la zona más sensible a la hipo-oxigenación es la espira basal de la cóclea, con lo que se afectarían las frecuencias más altas; sin embargo, no es este siempre el caso, y lo más frecuente es encontrar un umbral auditivo plano (es decir, una disfunción coclear similar a lo largo de toda la cóclea).
• Alteración de la homeostasis coclear por disfunción de canales iónicos celulares de potasio. Se ha documentado que la cocaína bloquea rápidamente estos canales, presentes en las células ciliadas del oído interno y responsables de mantener el potencial de membrana en reposo y así contribuir a la excitabilidad celular.
• Microembolismos, ya que las arterias cocleares no tienen colaterales; sin embargo, parece improbable que se produzca una embolia bilateral limitada a la cóclea sin otra clínica neurológica.
• En casos de pérdida súbita auditiva unilateral se presupone una hemorragia intralaberíntica [110].
• Otras hipótesis alternativas propuestas son la toxicidad coclear directa, daño nervioso, reducción de los potenciales de acción generados (debido al efecto anestésico local) e incluso se ha postulado que sea debido a una reacción autoinmune.
• Por último, no se puede excluir que el causante de la pérdida de audición sea, en realidad, alguna de las sustancias adicionadas a la cocaína [113]; y se ha demostrado que la heroína también puede inducir déficit auditivo, por lo que puede ser un factor de confusión [113]. También se ha descrito pérdida bilateral de audición tras speedballing [109].
• Por otra parte, la exposición prenatal a la cocaína se ha asociado a déficit de audición y a anomalías en el procesamiento central de la audición que en ocasiones pueden resolverse con el desarrollo (pero estos niños tienen riesgo de retraso del lenguaje y cognitivo) [114-115].
ENFISEMA SUBCUTÁNEO CERVICAL
El enfisema subcutáneo (y otras alteraciones asociadas) pueden ser una complicación, aunque infrecuente, del consumo de cocaína, habiéndose descrito varios casos en la literatura [116-124].
El mecanismo fisiopatológico exacto todavía se desconoce, pero se cree que está en relación con el barotrauma producido con la inhalación de cocaína. Este se produce tras la inhalación profunda y la maniobra de Valsalva que realizan los consumidores con el fin de aumentar el efecto de la sustancia; lo que aumenta la presión alveolar y el gradiente broncovascular y puede producir una ruptura alveolar marginal (lo que se conoce como efecto Macklin), bronquial o incluso a nivel traqueal [121-124]. El aire puede llegar hasta el mediastino y posteriormente avanzar por la fascia cervical profunda provocando enfisema subcutáneo [116,120-124].
Por otra parte, puede que el efecto citotóxico directo de la cocaína también juegue un papel en la ruptura de los alveolos debilitando la pared alveolar [122-123].
Por lo general, el enfisema subcutáneo y el neumomediastino tienen un curso benigno y autolimitado que solo requiere observación y manejo conservador. Sin embargo, cuando ocurre es importante descartar el compromiso respiratorio, que de producirse puede requerir drenaje quirúrgico del aire acumulado [116-124].
OTRAS LESIONES EN VÍA AÉREA SUPERIOR
El consumo de cocaína puede llevar al desarrollo de otras patologías, menos conocidas, a lo largo de la vía aérea superior. Muchas están influenciadas por el contacto de la mucosa faringolaringea con el humo a gran temperatura que se produce al fumar crack [125].
Este tipo de lesiones son mucho más frecuentes en la región supraglótica debido al mecanismo protector de cierre de la epiglotis sobre la glotis, desencadenado tras estímulos irritativos como el calor (por lo que en la zona subglótica el daño es únicamente producido por mecanismos químicos, mientras que en la región supraglótica también actúan mecanismos físicos) [126]. Estas lesiones están favorecidas por el efecto anestésico de la cocaína al entrar en contacto con la mucosa [127-128].
La complicación más temida a nivel faringolaríngeo es el compromiso de la vía aérea debido a la inflamación y al edema secundario al daño local, que puede amenazar la vida del paciente. Esta complicación puede aparecer como una inflamación aguda de la mucosa de la vía aérea superior, pudiendo llegar a precisar traqueostomía urgente para asegurar la vía aérea [131-140].
Otra posible manifestación faríngea del consumo de cocaína es la aparición de quistes saculares, raras anomalías que parecen tener relación con el aumento de presión, secundario a accesos de tos tras inhalaciones vigorosas por el efecto irritativo de la cocaína sobre la mucosa [141]. El diagnóstico se puede complementar con pruebas de imagen como tomografía computerizada o resonancia magnética nuclear.
La clínica más habitual incluye afonía, disnea, estridor, odinofagia y disfagia, por afectación de laringe y faringe [125-131].
Las lesiones que pueden aparecen en la región faringolaríngea en relación al consumo de cocaína se resumen en la Tabla 2.
Tabla 2. Lesiones faringolaríngeas asociadas al consumo de cocaína.
Faringe |
Erosiones superficiales [249, 250, 253, 254] |
Supraglotis |
Supraglotitis térmica [248] |
Glotis |
Pólipos [252, 255, 256] |
Subglotis |
Hiperplasia de epitelio respiratorio [252, 255, 256] |
CONCLUSIONES
El consumo de cocaína puede acarrear graves consecuencias para la salud. La perforación septal y la necrosis de la línea media facial son las más frecuentes y conocidas; sin embargo, son muchas y muy variadas las manifestaciones que el consumo de cocaína puede ocasionar en el área de cabeza y cuello, y muchas de ellas pueden ser confundidas con otras patologías sistémicas o acarrear graves consecuencias si no son tratadas con prontitud, por lo que es necesario mantener un alto índice de sospecha, incluso aún cuando el paciente niega el consumo de sustancias tóxicas.
CONFLICTO DE INTERESES
Este artículo incluye contenidos del TFG titulado Manifestaciones otorrinolaringológicas derivadas del consumo de cocaína, presentado por la autora Beatriz Palmero Sánchez para obtener el título de Grado en Medicina por la Facultad de Medicina de la Universidad de Cantabria.
BIBLIOGRAFÍA
1.Blanco GF, Madeo MC, Martínez M, Vázquez ME. Case for diagnosis. Palate perforation due to cocaine use. An Bras Dermatol. 2017;92(6):877–878.
2.Marí A, Arranz C, Gimeno X, et al. Nasal cocaine abuse and centrofacial destructive process: report of three cases including treatment. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2002;93(4):435–439.
3.Lee CY, Mohammadi H, and Dixon RA. Medical and dental implications of cocaine abuse. J Oral Maxillofac Surg.1991;49:290-3.
4.Goodger NM, Wang J, Pogrel MA. Palatal and nasal necrosis resulting from cocaine misuse. Br Dent J. 2005;198(6):333–334.
5.Trimarchi M, Bussi M, Sinico RA, Meroni P, Specks U. Cocaine-induced midline destructive lesions — An autoimmune disease? Autoimmun Rev. 2013;12(4):496–500.
6.RIezzo I, Fiore C, De Carlo D, Pascare N, Neri M, Turillazzi E, Fineschi V. Side Effects of Cocaine Abuse: Multiorgan Toxicity and Pathological Consequences. Current Med Chemistry. 2012;19,5624-5646
7.Dwyer C, Sowerby L, Rotenberg B. Is Cocaine a Safe Topical Agent for Use During Endoscopic Sinus Surgery? Laryngoscope. 2016;126,1721-1723.
8.Villa PD. Midfacial complications of prolonged cocaine snorting. J Can Dent Assoc. 1999;65(4):218–223.
9.Estroff TW, Gold MS. Medical and psychiatric complications of cocaine abuse with possible points of pharmacologic treatment. Adv Alcohol Subst Abuse. 1985;5:61-76.
10. Rao AN. Brain abscess: a complication of cocaine inhalation. NY State J Med 1988;548-50.
11. Newman NM, DiLoreto DA, Ho JT, Klein JC, Birnbaum NS. Bilateral optic neuropathy and osteolytic sinusitis. Complications of cocaine abuse. JAMA. 1988; 259:72-4.
12. Gontijo B, Bittencourt FV, Lourenço LFS. Skin manifestations of illicit drug use. An Bras Dermatol. 2006;81:307-17.
13. Goldstein FJ. Toxicity of cocaine. Compendium, 1990;11:710,712,714-6.
14. Isaacs SO, Martin P, and Willoughby JH. «Crack» (an extra potent form of cocaine) abuse: a problem of the eighties. Oral Surg Oral Med Oral Patho. 1987; 63:12-6.
15. Schweitzer V. Osteolytic sinusitis and pneumomediastinum: deceptive otolarygologic complications of cocaine abuse. Laryngoscope. 1986;96:206-10.
16. Kapila YL, Kashani H. Cocaine-associated rapid gingival and dental erosion: a case report. J periodontal. 1997;68:485-8.
17. Parry J, Porter S, Scully C, Flint S, Parry MG. Mucosal lesions due to oral cocaine use. Br Dent J. 1996;180:462-4.
18. Gonalez-Mariño I, Baz-Lomba JA, Alygizakis NA, Andres-Costa MJ, Bade R, Barron LP et. al. Spatio-temporal assessment of illicit drug use at large scale: evidence from 7 years of international wastewater monitoring. Addiction. 2020;115:109–120.
19. European Drug Report 2019: Trends and Developments. Luxembourg. EMCDDA, Lisbon, June 2019
20. Das G. Cardiovascular effects of cocaine abuse. Int J Clin Pharmacol Ther Toxicol 1993; 31:521-8.
21. Silvestre FJ, Salort-Llorca C, Mínguez-Serra MP, Silvestre-Rangil J. Cocaine-related oronasal communication and hard palate destruction. J Investig Clin Dent 2012;3:157–160
22. Blaise G, Vanhooteghem O, De La Brassinne M. Perforation de la cloison nasale dans un contexte d’inhalation de cocaïne. Rev Med Liege. 2005;60:845–8.
23. Sastry RC, Lee D, Har-EI G. Palate perforation from cocaine abuse. Otolaryngol Head Neck Surg. 1997;116:565-6.
24. Mattson-Gates G, Jabs AD, Hugo NE. Perforation of the hard palate associated with cocaine abuse. Ann Plast Surg 1991;26:446–8.
25. Myon L, Delforge A, Raoul G, Ferri J. Nécrose palatine par consommation de cocaïne. Rev Stomatol Chir Maxillofac 2010;111(1):32–35.
26. Schwarz RH, Estroff T, Fairbanks DNF, Hoffman NG. Nasal symptoms associated with cocaine abuse during adolescence. Arch Otolaryngol Head Neck Surg 1989;115:63-4.
27. Lee KC, Ladizinski B, Federman DG. Complications associated with use of levamisole-contaminated cocaine: an emerging public health challenge. Mayo Clin Proc 2012;87(6):581-586.
28. Gross RL, Brucker J, Bahce-Altuntas A, Abadi MA, Lipoff J, Kotlyar D, et al. A novel cutaneous vasculitis syndrome induced by levamisole-contaminated cocaine. Clin Rheumatol 2011;30(10):1385–1392.
29. Gandara-Rey JM, Diniz-Freitas M, Gándara-Vila P, Blanco-Carrión A, García-García A. Lesions ot the oral mucosa in cocaine users who apply the drug topically. Med Oral 2002;7:103–7.
30. Smith JC, Kacker A, Anand VK. Midline nasal and hard palate destruction in cocaine abusers and cocaine¢s role in rhinologic practice. Ear Nose Throat J 2002;81:172–7.
31. Agusti-Mejias A, Messeguer F, García R, Sánchez JL, Alegre V. Sinusitis destructiva masiva secundaria a consumo inhalado de cocaína [Massive destructive sinusitis following cocaine inhalation]. Med Clin (Barc) 2012;138(9):414.
32. Kurloff DB, Kimmelman CP. Osteocartilaginous necrosis of the sinonasal tract following cocaine abuse. Laryngoscope 1989;99:918-24.
33. Sittel C, Eckel HE. Nasal cocaine abuse presenting as a central facial destructive granuloma. Eur Arch Otorhinolaryngol 1998;255:446-7.
34. Molteni M, Saibene AM, Luciano K, Maccari A. Snorting the clivus away: an extreme case of cocaine-induced midline destructive lesion. BMJ Case Rep 2016;2016:1-5 bcr2016216393.
35. Tartaro G, Rauso R, Bux A, Santagata M, Colella G. An unusual oronasal fistula induced by prolonged cocaine snort. Case report and literature review. Minerva Stomatol 2008;57:203–10.
36. Deutsch HL, Millard DR. A new cocaine abuse complex. Involvement of nose, septum, palate, and pharynx. Arch Otolaryngol Head Neck Surg 1989;115:235–237.
37. Rubin K. The manifestation of cocaine-induced midline destructive lesion in bone tissue and its identification in human skeletal remains. Forensic Sci Int 2013; 231(1-3):408e1-408e11
38. Colletti G, Allevi F, Valassina D, Bertossi D, Bibglioli F. Repair of cocaine-related oronasal fistula with forearm radial free flap. J Craniofac Surg 2013;24:1734–8.
39. Padilla-Rosas M, Jimenez-Santos CI, García-González CL. Palatine perforation induced by cocaine. Med Oral Patol Oral Cir Bucal 2006;11:239–42.
40. Bianchi FA, Gerbino G, Tosco P, Tanteri G, Gatti G, Ramieri G. Progressive midfacial bone erosion and necrosis: case report and differential diagnosis. J Craniomaxillofac Surg 2014;42(8):1698–1703.
41. Bonner Osorio CB, Castillo López IY. Lesión destructiva de la línea media inducida por cocaína. Comunicación de un caso. An Oral Mex 2009;54:32-5.
42. Plaza G, Espinoza A, Ferrando J, Pinedo F. Granulomatosis de Wegener y lesiones destructivas de la línea media facial por cocaína: diagnóstico diferencial. Med Clin 2009;133:237-8.
43. Talbott JF, Gorti GK, Koch RJ. Midfacial osteomyelitis in a chronic cocaine abuser: a case report. Ear Nose Throat J 2001;80:738–43.
44. Vilela RJ, Langford C, McCullagh L, Kass ES. Cocaine-induced oronasal fistulas with external nasal erosion but without palate involvement. Ear Nose Throat J 2002;81:562–3.
45. Trimarchi M, Nicolai P, Lombardi D, Facchetti F, Morassi ML, Maroldi R, et al: Sinonasal osteocartilaginous necrosis in cocaine abusers: experience in 25 patients. Am J Rhinol 2003;17:33–43.
46. Noskin GA, Kalish SB. Pott's puffy tumor: A complication of intranasal cocaine abuse. Rev Infect Dis 1991;13:606-8.
47. Silvestre FJ, Perez-Herbera A, Puente-Sandoval A, Bagán JV: Hard palate perforation in cocaine abusers: a systematic review. Clin Oral Investig 2010;14:621–628.
48. Armstrong M Jr, Shikani AH. Nasal septal necrosis mimicking Wegener’s granulomatosis in a cocaine abuser. Ear Nose Throat J 1996; 75:623-6
49. Bacciu A, Ghirelli M, Ingegnoli A, Bozzetti F. Cocaine-Induced Midline Destructive Lesions Associated With Erosion of the Eustachian Tube. JAMA Otolaryngol Head Neck Surg. 2018;144(9):846–848.
50. Trimarchi M, Gregorini G, Facchetti F, Morassi ML, Manfredini C, Maroldi R, et al. Cocaine-induced midline destructive lesions: Clinical, radiographic, histopathologic, and serologic features and their differentiation from Wegener granulomatosis. Medicine (Baltimore) 2001;80(6):391–404.
51. Seyer BA, Grist W, Muller S. Aggressive destructive midfacial lesion from cocaine abuse. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2002;94(4):465–470.
52. Gaulard P, Henni T, Marolleau JP, Haioun C, Henni Z, Voisin MC, et al. Lethal midline granuloma (polymorphic reticulosis) and lymphomatous granulomatosis: evidence for a monoclonal T-cell lymphoma proliferative disorder. Cancer 1988;62:705-10.
53. Contreras Molina P, Flores Carmona E, Muñoz Palza CA, Tenor Serrano RL. Complicaciones nasales y orbitarias secundarias al abuso de cocaína inhalada. Acta Otorrinolaringol Esp 2012;63(3):233–236.
54. Tsokos M, Fauci AS, Costa J. Idiopathic midline destructive disease (IMDD): a subgroup of patients with the «midline granuloma» syndrome. Am J Clin Pathol 1982;77:162-8.
55. Rodrigo JP, Suarez C, Rinaldo A, Devaney KO, Carbone A, Barnes L, et al. Idiopathic midline destructive disease: fact or fiction. Oral Oncol 2005;41(4): 340-348.
56. Trimarchi M, Bondi S, Della Torre E, Terreni MR, Bussi M. Palate perforation differentiates cocaine-induced midline destructive lesions from granulomatosis with polyangiitis.. Acta Otorhinolaryngol Ital 2017;37(4):281–285.
57. Trimarchi M, Gregorini G, Facchetti F, Morassi ML, Manfredini C, Maroldi R, et al: Cocaine-induced midline destructive lesions: clinical, radiographic, histopathologic, and serologic features and their differentiation from Wegener granulomatosis. Medicine (Baltimore) 2001;80:391–404.
58. Colletti G, Autelitano L, Chiapasco M, Biglioli F, Giovanditto F, Mandalà M, et al. Comprehensive Surgical Management of Cocaine-Induced Midline Destructive Lesions. J Oral Maxillofac Surg 2014;72(7):1395.e1-1395.e10.
59. Matsumura T, Sato-Matsumura KC, Ota M, et al. Two cases of pyoderma gangrenosum complicated with nasal septal perforation. Br J Dermatol 1999;141:1133-5
60. Trimarchi M, Nicolai P, Lombardi D, Facchetti F, Morassi LM, Maroldi R, et al: Sinonasal osteocartilaginous necrosis in cocaine abusers: experience in 25 patients. Am J Rhinol 2003;17(1):33-43.
61. Arora NP, Jain T, Bhanot R, Natesan SK. Levamisole-induced leukocytoclastic vasculitis and neutropenia in a patient with cocaine use: an extensive case with necrosis of skin, soft tissue, and cartilage. Addict Sci Clin Pract 2012;7:19.
62. Poon SH, Baliog CR Jr, Sams RN, Robinson-Bostom L, Telang GH, Reginato AM. Syndrome of cocaine-levamisole-induced cutaneous vasculitis and immune-mediated leukopenia. Semin Arthritis Rheum 2011;41:434-444
63. Formeister EJ, Falcone MT, Mair EA. Facial cutaneous necrosis associated with suspected levamisole toxicity from tainted cocaine abuse. Ann Otol Rhinol Laryngol 2015;124(1):30–34.
64. Neugebauer P, Fricke J, Neugebauer A, Kirsch A, Rüssmann W. Sinuorbital complications after intrana- sal cocaine abuse. Strabismus 2004;12:205–209.
65. Valmaggia C, Gottlob IM. Cocaine abuse, generalized myasthenia, complete external ophthalmoplegia, and pseudotonic pupil. Strabismus 2001;9(1):9–12.
66. Ayala C, Watkins L, Deschler DG. Tension orbital pneumocele secondary to nasal obstruction from cocaine abuse: a case report. Otolaryngol Head Neck Surg 2002;127(6):572–574.
67. Siemerink MJ, Freling NJM, Saeed P. Chronic orbital inflammatory disease and optic neuropathy associated with long-term intranasal cocaine abuse: 2 cases and literature review. Orbit 2017;36(5):350–355.
68. Brown E, Prager J, Lee HY, Ramsey RG. CNS complications of cocaine abuse: prevalence, pathophysiology, and neuroradiology. AJR Am J Roentgenol 1992;159:137-47.
69. Sawicka EH, Trosser A. Cerebrospinal fluid rhinorrhoea after cocaine sniffing. Br Med J (Clin Res Ed) 1983;286:1476-7.
70. Stringfellow HF, Khan IA, Sissons MCJ. Solitary fibrous tumor arising in the nasal cavity: report of a case. J Laryngol Otol 1996;110:468–470.
71. Alameda F, Fontane J, Corominas JM, Lloreta J, Serrano S. Reactive vascular lesion of nasal septum simulating angiosarcoma in a cocaine abuser. Hum Pathol 2000;31(2):239–241.
72. Kessler A, Lapinsky J, Berenholz L, Sarfaty S, Segal S. Solitary fibrous tumor of the nasal cavity. Otolaryngol Head Neck Surg 1999;121:826–828.
73. Chauhan SS, Krishnan J, Heffner DK. Solitary fibrous tumor of nasal cavity in patient with long-standing history of cocaine inhalation. Arch Pathol Lab Med 2004;128(1):1–4.
74. Ronda JM, Sancho M, Lafarga J, Gras JR, Aracil A. Necrosis mediofacial secundaria al abuso de cocaína. Acta Otorrinolaringol Esp 2002;53(2):129–132.
75. Wolford A, McDonald TS, Eng H, HanselS, ChenY, Bauman J, et al. Immune- mediated agranulocytosis caused by the cocaine adulterant levamisole: a case for reactive metabolite(s) involvement. Drug Metab Dispos 2012; 40:1067–75
76. Winter K, Ritter R, Viera AJ. Painful ear nodules. J Fam Pract 2013;62(9):503–505
77. Centers for Disease Control and Prevention (CDC): Agranulocytosis associated with cocaine use—four States, March 2008-November 2009. MMWR Morb Mortal Wkly Rep 2009, 58:1381–1385.
78. Chang A, Osterloh J, Thomas J: Levamisole: a dangerous new adulterant. Clin Pharmacol Ther 2010;88(3):408–411.
79. Casale JF, Corbeil EM, Hays PA: Identification of levamisole impurities found in illicit cocaine exhibits. Microgram J 2008;6(3,4):82–89.
80. Pearson T, Bremmer M, Cohen J, Driscoll M. Vasculopathy related to cocaine adulterated with levamisole: a review of the literature. Dermatol Online J 2012;18(7):1.
81. Ching JA, Smith DJ. Levamisole-induced necrosis of skin, soft tissue, and bone: case report and review of literature. J Burn Care Res 2012;33:1-5.
82. Magliocca KR, Coker NA, Parker SR. The head, neck, and systemic manifestations of levamisole-adulterated cocaine use. J Oral Maxillofac Surg 2013;71(3):487–92.
83. Graf J, Lynch K, Yeh CL, et al. Purpura, cutaneous necro- sis, and antineutrophil cytoplasmic antibodies associated with levamisole-adulterated cocaine. Arthritis Rheum 2011;63(12):3998-4001.
84. Bradford M, Rosenberg B, Moreno J, Dumyati G. Bilateral Necrosis of Earlobes and Cheeks: Another Complication of Cocaine Contaminated With Levamisole. Ann Intern Med 2010;152(11):758.
85. Fazzi M, Vescovi P, Savi A, Manfredi M, Peracchia M. Effeti delle drogue sul cavo orale. Minerva Estomatol 1999;48:485-92.
86. Cury PR, Araujo NS, das Graças Alonso Oliveira M, Dos Santos JN. Association between oral mucosal lesions and crack and cocaine addiction in men: a cross-sectional study. Environ Sci Pollut Res Int 2018;25(20):19801–19807.
87. Gándara Rey J M, Diniz Freitas M, Gándara Vila P, Blanco Carrión A, García García A. Lesiones inducidas por la aplicación tópica de cocaína. Medicina Oral 2002;7:103-7.
88. Biasotto M, Perinetti G, Serroni I, Ottaviani G, Di Lenarda R, Tirelli G. Oral manifestation upon short time cocaine abuse. A case report. Minerva Stomatol 2012;61(6):295–8.
89. Cury PR, Oliveira MGA, de Andrade KM, de Freitas MDS, dos Santos JN. Dental health status in crack/cocaine-addicted men: a cross-sectional study. Environ Sci Pollut Res 2017;24(8):7585–90.
90. Brown RS, Johnson CD. Corrosion of gold restorations from inhalation of «crack» cocaine. Gen Dent 1994;242-6.
91. Antoniazzi RP, Sari AR, Casarin M, Moraes CMB, Feldens CA. Association between crack cocaine use and reduced salivary flow. Braz Oral Res 2017;31:42.
92. Hofbauer GF, Burg G, Nestle FO. Cocaine-related Stevens-Johnson syndrome. Dermatology 2000;201(3):258–260.
93. Brenner S, Bialy-Golan A, Ruocco V. Drug-induced pemphigus. Clin Dermatol 998;16:393-7.
94. Brenner S, Goldberg I. Drug-induced pemphigus. Clin Dermatol 2011;29:455-7
95. Pile HD, Yarrarapu SNS, Crane JS. Drug-Induced Pemphigus. 2021 StatPearls. StatPearls Publishing; 2021 Jan 5. In StatPearls. PMID: 29763039.
96. Laguna C, Sánchez-Carazo J, Pérez-Ferriols A, Alegre V. Pemphigus vulgaris associated with cocaine snorting. J Eur Acad Dermatology Venereol 2008;22:645–6.
97. Ngo JT, Trotter MJ, Robertson LH. Pemphigus vegetans associated with intranasal cocaine abuse. J Cutan Med Surg 2012;16(5):344–349
98. Blaise B, Buescher L, Wilson ML. Multiple mucocutaneous ulcers associated with cocaine-induced midline destructive lesions. Dermatol Online J. 2016;22(9).
99. You P, Chow L, Dworschak-Stokan A, Husein M. Velopharyngeal dysfunction from intranasal substance abuse: Case series and review of literature. Laryngoscope 2018;128(12):2721–2725.
100. Yewell J, Haydon R, Archer S, Manaligod JM. Complications of intranasal prescription narcotic abuse. Ann Otol Rhinol Laryngol. 2002;111: 174–177
101. DiCosola M, Turco M, Acero J, Navarro-Vila C, Cortelazzi R. Cocaine-related syndrome and palatal reconstruction: report of a series of cases. Int J Oral Maxillofac Surg. 2007;36:721–727
102. Birchenough SA, Borowitz K, Lin KY. Complete soft palate necrosis and velo- pharyngeal insufficiency resulting from intranasal inhalation of prescription narcotics and cocaine. J Craniofac Surg 2007;18:1482–1485.
103. Braverman I, Raviv E, Frenkiel S. Severe avascular necrosis of the nasal chambers secondary to cocaine abuse. J Otolaryngol 1999;28:351–353
104. Greene D. Total necrosis of the intranasal structures and soft palate as a result of nasal inhalation of crushed OxyContin. Ear Nose Throat J 2005;84:512,514,516.
105. Cintra HL, Basile FV, Tournieux TT, Pitanguy I, Basile AR. Midline palate perforation secondary to cocaine abuse. J Plast Reconstr Aesthetic Surg 2008;61:588–590.
106. Ciorba A, Bovo R, Prosser S, Martini A. Considerations on the physiopathological mechanism of inner ear damage induced by intravenous cocaine abuse: cues from a case report. Auris Nasus Larynx 2009;36(2):213–217.
107. Stenner M, Stürmer K, Beutner D, Klussmann JP. Sudden bilateral sensorineural hearing loss after intravenous cocaine injection: a case report and review of the literature. Laryngoscope 2009;119(12):2441–2443.
108. Schweitzer VG, Darrat I, Stach BA, Gray E. Sudden bilateral sensorineural hearing loss following polysubstance narcotic overdose. J Am Acad Audio 2011;22(4):208–214.
109. Fowler CG, King JL. Sudden bilateral sensorineural hearing loss following speedballing. J Am Acad Audiol 2008;19(6):461–464.
110. Nicoucar K, Sakbani K, Vukanovic S, Guyot J-P. Intralabyrinthine haemorrhage following cocaine consumption. Acta Otolaryngol 2005;125(8):899–901.
111. Bauman JL, Di Domenico RJ. Cocaine-induced channelopathies: emerging evidence on the multiple mechanisms of sudden death. J Cardiovasc Pharmacol Ther 2002;7:195–202.
112. Shivapuja BG, Gu ZP, Saunders SS, Quirk WS. Acute effects of cocaine on cochlear function. Hear Res 1993;69:243–250.
113. Leri F, Bruneau J, Stewart J. Understanding polydrug use: review of heroin and cocaine co-use. Addiction 2003;98:7–22.
114. Cone-Wesson B. Prenatal alcohol and cocaine exposure: Influences on cognition, speech, language, and hearing. J Commun Disord 2005;38(4):279–302.
115. Church MW, Crossland WJ, Holmes PA, Overbeck GW, Tilak JP. Effects of prenatal cocaine on hearing, vision, growth, and behavior. Ann N Y Acad Sci 1998;846:12–28.
116. Alnas M, Altayeh A, Zaman M. Clinical course and outcome of cocaine-induced pneumomediastinum. The American Journal of the Medical Sciences 2010;339(1):65–67
117. Luque III MA, Cavallaro DL, Torres M, Emmanual P, Hillman JV. Pnuemomediastinum, pneumothorax, and subcutaneous emphysema after alternate cocaine inhalation and marijuana smoking. Pediatr Emerg Care 1987;3:107–9.
118. Aroesty DJ, Stanley RB, Crockett DM. Pneumomediastinum and cervical emphysema from the inhalation of «free based» cocaine: report of three cases. Otolaryngol Head Neck Surg 1986;94: 372–4.
119. Riccio JC, Abbott J. A simple sore throat? Retropharyngeal emphysema secondary to free-basing cocaine. J Emerg Med 1990;8:709–12.
120. Onwudike M. Ecstasy induced retropharyngeal emphysema. Emergency Medicine Journal 1996;13(5):359–36.
121. Soares DS, Ferdman A, Alli R. Subcutaneous emphysema and pneumomediastinum following cocaine inhalation: a case report. J Med Case Rep 2015;9:195.
122. Atmaca Temrel T, Şener A, İçme F, Gökhan Ş, Otal Y, Kurtoğlu Çelik G, et al. Subcutaneous Emphysema, Pneumomediastinum, and Pneumorrhachis after Cocaine Inhalation. Case Rep Emerg Med 2015;2015:134816.
123. Kanu O, Teleb M, Agrawal H, Cashin LB. Cocaine-related subcutaneous emphysema, pneumorrhachis and pneumomediastinum: a rare clinical finding. BMJ Case Rep 2017;2017:bcr2017219851.
124. Jaensch S, Hwang S, Kuo TS. Spontaneous Pneumomediastinum and Subcutaneous Emphysema following Cocaine Inhalation and Ecstasy Ingestion. Case Rep Otolaryngol 2019;2019:697-731.
125. Reino AJ, Lawson W: Upper airway distress in crack-cocaine users. Otolaryngol Head Neck Surg 1993;109:937-940
126. Osborne R, Avitia S, Zandifar H, Brown J. Adult supraglottitis subsequent to smoking crack cocaine. Ear Nose Throat J 2003;82(1):53–55.
127. Haddad F, Riachi M, Yazigi A, Madi-Jebara S, Hayek G, El Rassi I. Supraglottic edema and cocaine crack abuse. Br J Anaesth 2006; 97:900-901.
128. Ludwig WG, Hoffner RJ. Upper airway burn from crack cocaine pipe screen ingestion. Am J Emerg Med 1999;17:108-109
129. Silverman RS, Lee-Chiong TL Jr, Sherter CB. Stridor from edema of the arytenoids, epiglottis, and vocal cords after use of free-base cocaine. Chest 1995; 108:1477-8.
130. Ginsberg GG, Lipman TO. Endoscopic diagnosis of thermal injury to the laryngopharynx after crack cocaine ingestion. Gastrointest Endosc 1993;39:838-839.
131. Singh A, Thawani R, Thakur K. Crack cocaine-induced laryngeal injury. Am J Emerg Med 2017; 35:38.
132. Snyderman C, Weissman J, Curtin H. Crack cocaine burns of the larynx. Arch Otolaryngol Head Neck Surg 1991;117:792-795.
133. Taylor RF, Bernard GR. Airway complications from free-basing cocaine. Chest 1989;95:476-7.
134. Bernardes Filho F, Silva YB, Martins LG, Sasso LS, Abreu MA. Fingertip and nasal tip thermal burn in crack cocaine user. An Bras Dermatol 2013;88(5):850–852.
135. Kinsey CM, Howell M. A 27-year-old woman with a swollen uvula, chest pain, and elevated creatinine phosphokinase levels. Chest 2008;133(3):809–811.
136. Welling A. Enlarged uvula (Quincke's Oedema) a side effect of inhaled cocaine? A case study and review of the literature. Int Emerg Nurs 2008;16(3):207–210.
137. Hidalgo Mora JJ, Giménez de Llano E, Sempere Verdú E, Feliú Sagalá M. Angioedema de úvula tras consumo de cocaína por vía intranasal. Med Clin (Barc) 2002;119(11):438–439.
138. Macfarlane R, Hart J, Henry JA. A man with a massive uvula. Lancet 2002;359(9305):492.
139. Kestler A, Keyes L. Images in clinical medicine. Uvular angioedema (Quincke's disease). N Engl J Med 2003;349(9):867.
140. Bezmalinovic Z, Gonzalez M, Farr C. Oropharyngeal injury possibly due to free-base cocaine. N Engl J Med. 1988;24:319:1420-1.
141. Desai DP, Portugal LG, Walner DL, Mafee MF, Schild JA. Bilateral saccular cysts after cocaine use. Otolaryngol Head Neck Surg. 1999;120(5):754–757.